Nel mese di marzo 2020, uno dei messaggi più ripetuti era quello lanciato dall’OMS: Test, Test, Test.
Con il passare dei mesi, l’uso dei
test diagnostici è stato ancor più sottolineato ed evidenziato come una azione da intraprendere per
contenere la diffusione di Covid-19.
I test diagnostici a disposizione sono innumerevoli e altri sono in via di sviluppo. E’ comunque fondamentale che ne venga stabilita la
sensibilità e specificità analitiche, così come la
sensibilità e specificità cliniche. La ricerca è in continua evoluzione ed è ben arduo oggi stabilire quale, tra i tanti test, sia il più “affidabile”.
Interpretazione dei test diagnostici per SARS-CoV-2
Come ci ricorda anche un
approfondimento di ARS Toscana, è stato recentemente pubblicato su JAMA Network il
viewpoint Interpreting Diagnostic Tests for SARS-CoV-2,
che descrive come interpretare i risultati e le variazioni nel tempo di 2 tipi di test diagnostici comunemente usati per la diagnosi di infezione da SARS-CoV-2 :
- la reazione di trascrizione inversa della polimerasi a catena (RT-PCR )
- IgM e IgG con dosaggi di immunoassorbimento a correlazione enzimatica (ELISA)
Finora, il
test più comunemente usato e affidabile per la diagnosi di COVID-19 è stato il
test RT-PCR eseguito utilizzando tamponi nasofaringei o altri campioni del tratto respiratorio superiore, prelevati mediante tampone oro-faringeo o, più recentemente, quello salivare.
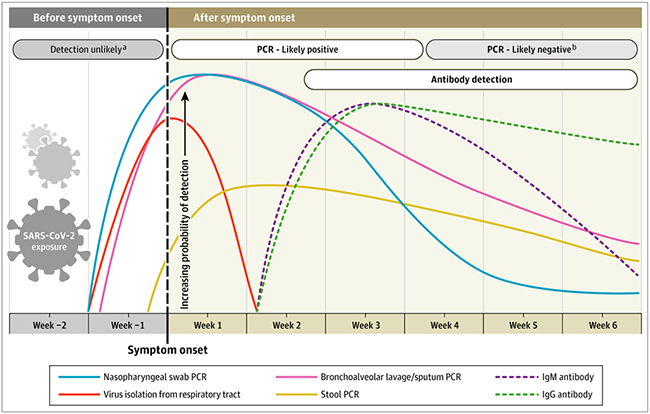
Nella maggior parte dei soggetti con
infezione sintomatica da COVID-19, l'
RNA virale, prelevato mediante tampone rinofaringeo, diventa
rilevabile già dal primo giorno in cui sono presenti i sintomi, con un
picco entro la prima settimana dal loro esordio. Questa positività nei casi lievi inizia a
diminuire entro la terza settimana divenendo, successivamente, non rilevabile.
Al contrario, in
pazienti ospedalizzati gravemente malati, la positività della
PCR può persistere oltre 3 settimane dopo l'insorgenza della malattia. Tuttavia, un risultato PCR "positivo" riflette solo il rilevamento dell'RNA virale e non indica necessariamente la presenza di virus vitale. In alcuni casi, l'RNA virale è stato rilevato mediante RT-PCR anche
oltre 6 settimane dal primo test positivo. Sono stati, inoltre, segnalati casi di positività anche dopo 2 test PCR negativi consecutivi eseguiti a distanza di 24 ore.
In base ai risultati di uno studio svolto su
205 pazienti con infezione da COVID-19 confermata, la positività RT-PCR è risultata più elevata nei campioni prelevati attraverso lavaggio broncoalveolare (93%), seguiti da espettorato (72%), tampone nasale (63%) e tampone faringeo (32%). Dato che la specificità dei test RT-PCR è del 100%, i risultati falsi negativi sono stati riscontrati principalmente a causa di una tempistica inappropriata nella raccolta del campione in relazione all'insorgenza della malattia e ad errori di campionamento, in particolare con i tamponi rinofaringei.
La
diagnosi sierologica è particolarmente importante per i pazienti con malattia da lieve a moderata, ma utile anche per identificare le persone immuni e potenzialmente "protette" dall'infezione. Gli anticorpi
IgM e IgG sono stati riscontrati positivi già dal quarto giorno dopo l'insorgenza dei sintomi, livelli più elevati vengono riscontrati nella seconda e terza settimana di malattia. La
sieroconversione di IgM e IgG si è verificata in tutti i pazienti
tra la terza e la quarta settimana di insorgenza della malattia clinica. Successivamente le IgM iniziano a diminuire e raggiungono livelli più bassi entro la quinta settimana, fino quasi a scomparire entro la settima settimana, mentre le IgG persistono oltre le 7 settimane.
Gli
anticorpi IgM e IgG testati mediante ELISA hanno una specificità maggiore al 95% per diagnosi di Covid-19, tuttavia dobbiamo ricordare che possono avere una reattività crociata con SARS-CoV e probabilmente altri coronavirus. Attualmente, sono stati ampiamente sviluppati e commercializzati
test rapidi per la rilevazione degli anticorpi, che possono indicare la presenza/assenza di SARS-CoV-2.
In conclusione, utilizzando le prove disponibili, gli autori hanno
delineato una sequenza temporale clinicamente utile di marker diagnostici per il rilevamento di COVID-19. La maggior parte dei dati disponibili riguarda le popolazioni adulte che non sono immunocompromesse, di conseguenza il decorso della positività alla PCR e la sieroconversione possono variare in specifici gruppi di popolazione (fra cui i soggetti asintomatici ed i bambini).
Rimane
ancora da stabilire per quanto tempo permanga l'immunità negli individui, sia asintomatici che sintomatici, che hanno contratto SARS-CoV-2.
Test sierologici: la revisione Cochrane e BMJ
Una recente
review della Cochrane ha focalizzato l’attenzione sui test sierologici, riportando importanti conclusioni.
- Nella prima settimana dall'esordio dei sintomi la sensibilità dei test sugli anticorpi è troppo bassa per avere un ruolo primario nella diagnosi di Covid-19, ma potrebbero comunque avere un ruolo complementare ad altri test diagnostici, quando ad es. i RT-PCR sono negativi o non sono eseguiti
- È probabile che i test sugli anticorpi siano utili nel rilevare la precedente infezione da SARS-CoV-2 se utilizzati 15 o più giorni dopo l'insorgenza dei sintomi. Tuttavia, la durata dell’incremento di anticorpi è attualmente sconosciuta e vi sono pochissimi dati oltre i 35 giorni dall'insorgenza della malattia. Pertanto, non vi è certezza assoluta dell'efficacia di questi test per le indagini sulla sieroprevalenza condotte nella popolazione generale
- L'elevato rischio di parzialità fa sì che l'accuratezza dei test, quando utilizzati nelle cure cliniche, sia inferiore rispetto a quanto riportato negli studi inclusi nella review
- Essendo la loro sensibilità spesso valutata in pazienti ospedalizzati, non è chiaro se i test siano in grado di rilevare livelli di anticorpi più bassi, osservati quando la malattia si presenta in forma più lieve e asintomatica
- La progettazione, esecuzione e comunicazione degli studi sull'accuratezza dei test per Covid-19 richiedono un notevole miglioramento. Le indagini devono riportare i dati sulla sensibilità, dall'esordio dei sintomi, disaggregati nel tempo, includere i casi positivi che sono RT-PCR negativi e quelli RT-PCR confermati, in conformità con quanto ha stabilito l'Organizzazione mondiale della sanità (OMS) e con la definizione dei casi della China National Health Commission della Repubblica popolare cinese (CDC).
Gli autori della review sottolineano anche che i dati prendono in esame solo una piccola parte dei test disponibili, che sono necessarie azioni per garantire che tutti i risultati delle valutazioni siano presentati e che proprio per questi motivi sono previsti
aggiornamenti continui di questa revisione sistematica.
Anche il
BMJ ha pubblicato una
revisione sistematica, specificando che il numero di test sierologici è aumentato rapidamente e molti sono commercializzati per uso point-of-care.
La base di prove a supporto dell'accuratezza diagnostica di questi test, tuttavia, non è stata valutata formalmente.
Le prove disponibili sull'accuratezza dei test sierologici per Covid-19 sono caratterizzate da rischi di parzialità ed eterogeneità e, come tale, stime di sensibilità e specificità sono inaffidabili e hanno una generalizzabilità limitata.
Attualmente,
le prove disponibili non supportano l'uso continuato dei test sierologici esistenti “point-of-care”.
Un’immagine aiuta a sintetizzare meglio.

Dispositivi diagnostici in vitro: quali sono utilizzati in Europa?
Dato che i
dispositivi diagnostici in vitro (In Vitro Diagnostic Device, IVD) rappresentano uno strumento essenziale per la gestione dell’epidemia di COVID-19, la
Commissione Europea ha pubblicato in data 15 aprile 2020 le
linee guida sui test diagnostici in vitro per COVID-19 e sulle loro prestazioni e un documento che propone una
definizione provvisoria dei criteri di “performance” dei test diagnostici dopo aver esaminato i dati pubblicamente disponibili su quelli marcati CE.
I criteri includono sensibilità analitica, specificità analitica, sensibilità clinica e specificità clinica.
A seguito di questo documento, la Commissione europea sta raccogliendo in una
banca dati consultabile, i
dati pubblici dei produttori dei test IVD in commercio marcati CE e rivedendo i
test in sviluppo basandosi sulle prestazioni descritte in articoli scientifici.
Anche L’ECDC ha recentemente pubblicato nel suo sito una news
Diagnostic testing and screening for SARS-CoV-2 tra le “Latest Evidence”, in cui vengono descritti i
vari tipi di test.
E in Italia, quali sono i test diagnostici per Covid-19?
I contenuti delle
linee guida Europee (è da notare che nella traduzione italiana è stato utilizzato il termine “
orientamenti”), relativi al contesto legislativo ed alla tipologia di dispositivi circolanti sul mercato sono specificamente trattati nel
Rapporto ISS Dispositivi diagnostici in vitro per COVID-19. Parte 1: normativa e tipologie.
Sempre ISS, nel
Rapporto Dispositivi diagnostici in vitro per COVID-19. Parte 2: evoluzione del mercato e informazioni per gli stakeholder, affronta le tematiche relative all’
evoluzione del mercato degli IVD per Covid-19 e fornisce informazioni per gli stakeholder (utilizzatori, distributori e fabbricanti) sul loro corretto utilizzo in relazione con la destinazione d’uso e con le prestazioni indicate dal fabbricante.
Viene specificato che in
Italia, una stima minima degli
IVD per COVID-19 commercializzati è stata effettuata monitorando quelli registrati nella banca dati “
Elenco dei dispositivi medici” del Ministero della Salute. Ciò è stato possibile in quanto fabbricanti e mandatari che immettono in commercio in Italia dispositivi medico-diagnostici in vitro hanno l’obbligo di registrare i propri dispositivi nella banca dati del Ministero della salute, mentre per coloro che risiedono all’estero questo avviene su base volontaria.
I
primi IVD per COVID-19 registrati in
Italia sono stati i
test per RNA virale e i
test sierologici rapidi a partire dalla seconda metà di febbraio, mentre i primi
test sierologici di laboratorio (ELISA, CLIA, CMIA) sono stati registrati solo
a partire dalla metà di marzo.
Nel giro di due mesi le registrazioni hanno raggiunto valori considerevoli per i test per RNA virale (n. 83) e, soprattutto, per i test sierologici rapidi (n.157 all’ultimo aggiornamento del 23 maggio), mentre la crescita delle registrazioni dei test sierologici di laboratorio (che comprendono test per le IgM, o le IgG, o le IgA, o per anticorpi totali) è più contenuta.
Il
sito web della FIND (Foundation for Innovative New Diagnostics) offre una
panoramica sulle
prestazioni (sensibilità e specificità) effettivamente rilevate da laboratori che, in tutto il mondo, volontariamente rendono disponibili i risultati ottenuti con le prove di laboratorio.
Per saperne di più:
immagine:
it.freepik.com