Secondo il rapporto
Human medicines highlights 2019 diffuso dall'Ema,
66 sono i farmaci autorizzati, di questi
30 contengono un nuovo principio attivo mai approvato nell’Unione europea e
7 sono prodotti orfani. Tra le novità vi sono anche
5 biosimilari, uno derivato dalla cannabis,
una terapia genica, due
antimicrobici per infezioni resistenti e
un vaccino, quello contro il virus Ebola. Prima di arrivare ai pazienti però, i farmaci dovranno ricevere il via libera delle agenzie dei singoli stati.

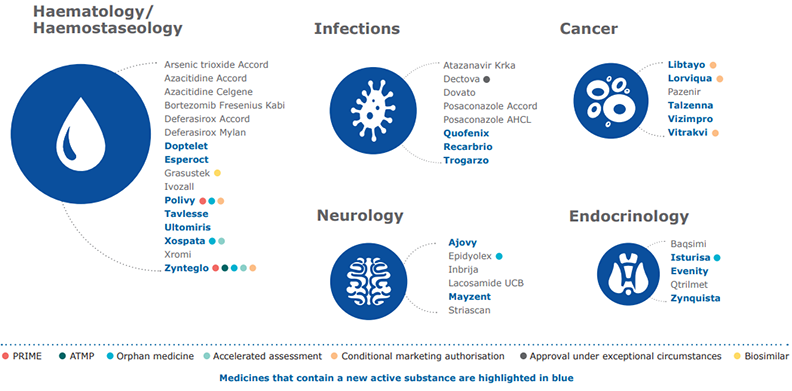
Tra i farmaci “che rappresentano progressi significativi nelle loro aree terapeutiche”, l’EMA segnala:
- Vitrakvi: il primo trattamento indipendente dall’istologia nell'Unione europea per i tumori solidi con fusione genica neurotrofica dei recettori tirosin-chinasi (NTRK)
- Sixmo: un trattamento sostitutivo per la dipendenza da oppioidi (che consiste in un impianto che rilascia bassi livelli di buprenorfina nel corpo per sei mesi)
- Epidyolex: per il trattamento delle convulsioni associate a due rare forme di epilessia, che è anche il primo derivato dalla cannabis a ricevere un parere positivo dall’UE
- Zynteglo: un medicinale per terapia avanzata della beta talassemia, una rara condizione ereditaria che provoca grave anemia, il farmaco è destinato ai pazienti adulti e adolescenti che necessitano di trasfusioni di sangue regolari per gestire la loro malattia e non hanno donatori corrispondenti per un trapianto di cellule staminali.
Ematologia, oncologia, neurologia, endocrinologia e le malattie infettive sono le aree maggiormente interessate.
In quest'ultima area in particolare è stato dato il via libera a un antibiotico per il trattamento delle infezioni della pelle resistenti dovute a ulcere o ferite (
Quofenix); un antibiotico per infezioni resistenti del tratto urinario (
Recarbrio); tre antivirali per l'HIV (
Atazanavir Krka, Trogarzo e Dovato); due generici per infezioni fungine (
Posaconazole Accord e Posaconazole AHCL) e un antivirale per il trattamento dei casi gravi e complicati di influenza (
Dectova).
Nell'ultimo anno l'Agenzia si è attivata anche in materia di sicurezza e ha raccomandato nuove
misure per
prevenire errori gravi e potenzialmente fatali:
- sul dosaggio del metotrexato nel trattamento delle malattie infiammatorie come l'artrite reumatoide, la psoriasi e la malattia di Crohn
- per il ritiro dal commercio dei medicinali a base di fenspiride a seguito di una revisione che ha confermato che potrebbero causare problemi cardiaci.
Nuovi farmaci: il percorso per l'autorizzazione all'immissione in commercio
Per tutelare la salute pubblica e assicurare la disponibilità di medicinali sicuri ed efficaci,
tutti i farmaci devono essere autorizzati prima di poter essere immessi sul mercato. Ciò presuppone un
processo di valutazione che può avvenire a livello europeo o nazionale. Per essere
commercializzato in Italia un medicinale deve aver ottenuto il rilascio dell’autorizzazione all’immissione in commercio (AIC) da parte dell’
AIFA o della
Commissione europea.
Le norme e i requisiti applicabili ai prodotti farmaceutici all’interno dell’Unione Europea sono gli stessi, indipendentemente dal percorso di autorizzazione utilizzato:
- l’AIC rilasciata con procedura nazionale ha validità solo in un paese
- se invece la procedura è centralizzata, allora è coordinata dall’EMA che lavora in rete con le autorità competenti di ciascuno stato membro. L’autorizzazione così ottenuta è valida in tutti i paesi dell’UE e in Islanda, Liechtenstein e Norvegia, gli stati dell’Associazione europea di libero scambio dello spazio economico europeo (SEE).
- con la procedura decentralizzata le aziende possono presentare domanda per l’autorizzazione in più di uno stato membro nel caso in cui il medicinale non sia ancora stato autorizzato in alcun paese UE e non rientri nella procedura centralizzata
- attraverso la cosiddetta procedura di mutuo riconoscimento invece l’AIC di un medicinale può essere estesa da uno stato ad altri stati.
L’uso della procedura centralizzata di autorizzazione è
obbligatorio per i medicinali più innovativi, per esempio quelli per le malattie rare.
Sulla base della valutazione scientifica dell’EMA, la
Commissione europea rilascia o rigetta, modifica o sospende le
autorizzazioni all’immissione in commercio, adotta provvedimenti validi per l’intera UE nel caso in cui venga individuato un
problema per la sicurezza in relazione a un prodotto autorizzato a livello nazionale o qualora siano considerate necessarie misure di regolamentazione per tutti gli stati.
Nell'opuscolo
Il sistema normativo europeo per i medicinali. Un approccio unitario alla regolamentazione dei medicinali in tutta l’Unione europea viene spiegato il funzionamento del sistema normativo europeo per l’approvazione dei medicinali, sono descritte in modo chiaro e succinto le modalità di autorizzazione e di
monitoraggio dei farmaci nell’Unione europea e il funzionamento di tutta la rete di regolamentazione.
Per saperne di più:
immagine: Angel Sinigersky on Unsplash



